Where there’s a will, there’s a way
流されて研究の道へ
僕は静岡県静岡市の出身です。大学は東北大学歯学部に入って、臨床の口腔外科に進んで、卒業後、市内の国立仙台病院(現仙台医療センター)歯科口腔外科に3年ほど勤務して、東北大学の歯学部に助手として戻ってきました。その後、ちょっとだけ文部省の派遣でアメリカに留学して、2002年に医学研究科の准教授、2008年から医工学研究科の教授になりました。
もともと研究を志向していたわけではなくて、勤務医にでもなれればいいな、くらいに思って大学入学しました。大学院進学も、学位あった方がいいよね、くらいの感覚でした。だから当時はずっと臨床をやっていくつもりでした。転機がきたのは2002年です。医学系研究科に創生応用医学研究センターができて、歯学部から人を出さなきゃいけないっていう話になって、知らないうちに僕が候補に選ばれていたんです。当時の学部長に呼ばれて、選ばれたけどどうする?って。当時助手だったんですけど、助教授にしてくれるっていうから、じゃあお願いします、と。それで、医学系研究科に異動したんですけど、その頃に教員の任期制の話も出てきて、そうなると業績あげないとまずいじゃないですか。最初は臨床をやりながら研究もやろうと思っていたんですけど、そんな生半可な気持ちだと、すぐにクビになるんじゃないかっていう危機感もありました。そこで、OCPコラーゲンという新規の生体材料の開発に取り組んだんです。
Just going to drift into research
I was born in Shizuoka City, Shizuoka Prefecture. After graduation, I worked in the oral and maxillofacial surgery department of the National Sendai Hospital (now Sendai Medical Center) for about 3 years, and then returned to Tohoku University’s School of Dentistry as an assistant professor. After that, I studied in the United States on a grant from the Ministry of Education, Culture, Sports, Science, and Technology, and became an associate professor at the Graduate School of Medicine in 2002 and a professor at the Graduate Graduate School of Biomedical Engineering in 2008.
I wasn’t originally interested in research; I just thought it would be nice if I could become a hospital dentist. It would be good to have a doctoral degree, too. The turning point came in 2002. The United Center for Advanced Research and Translational Medicine (ART) was established in the Graduate School of Medicine, and the School of Dentistry needed to send someone there. The dean of the School of Dentistry asked me whether I want to go. I was an assistant professor at the time, but they offered me a position as an associate professor, so I said, “Yes, please.” So, I was transferred to the Graduate School of Medicine. Around that time they were talking about a fixed-term system for faculty members. I had to make a lot of progress. At first, I would have done research activity while keeping clinical work, but I felt urgent that I would soon be fired if I didn’t have a half-hearted desire to do so. Then I started working on the development of a new biomaterial called OCP/Collagen.
OCPコラーゲン:革新的生体材料
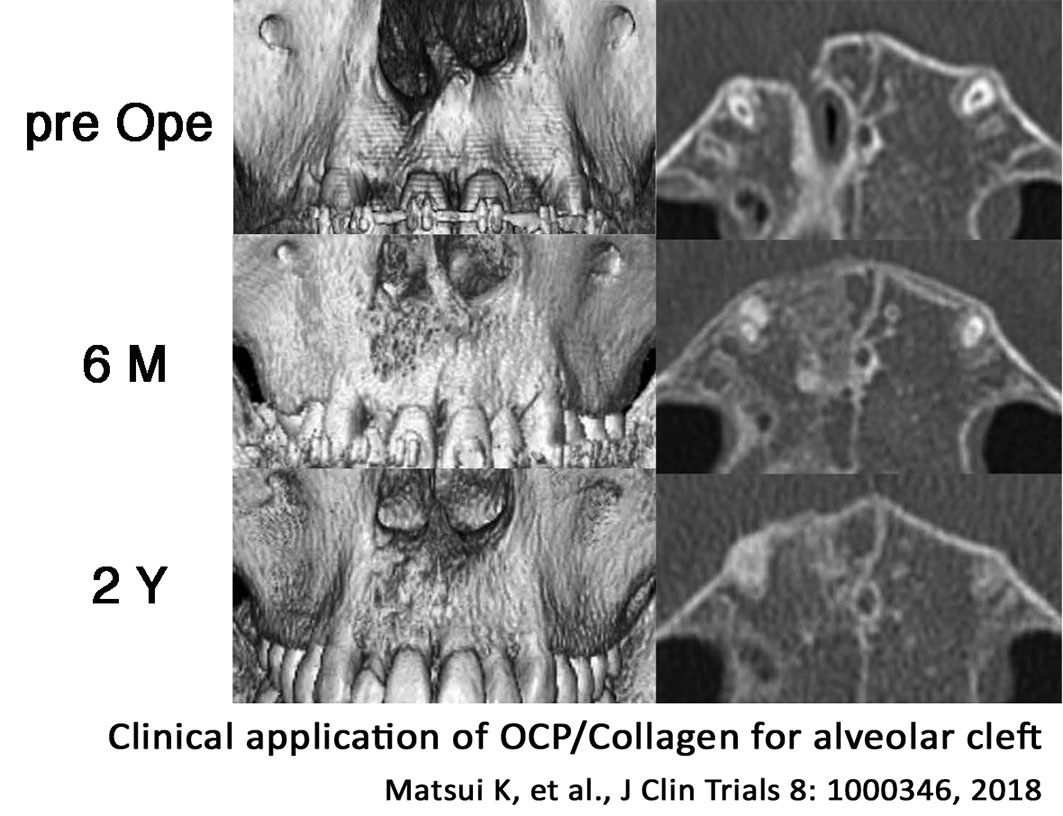
OCPコラーゲンの開発には、色々とありましたけど、かなりいいものができたと思います。それまでは、ハイドロキシアパタイトのような焼き固めた生体材料が主流でした。体には優しいんですけど骨のリモデリングサイクルに乗らないんですね。悪いことはしないんですけど変わりもしない。そのつぎに出てきた生体材料はβ-TCPなんですが、それは溶けてなくなっちゃう。OCPコラーゲンはそれらの生体材料と違って、骨芽細胞の分化を促すとか、血管を誘導するとかいう作用があることがわかってきました。従来の生体材料を使った場合、骨の周りからしか骨が再生されないのに対して、OCPコラーゲンだと材料の真ん中からでも骨ができる。だから再生スピードがものすごく速いです。自分の体に入れてもいいくらいだと思っています。適用は主に歯科治療で考えているのですが、整形外科にも応用可能だと思います。顎裂って歯茎に亀裂ある患者さんの治療にも適用できます。販売待ちで、患者さんに待機してもらっている状況です。
OCP/Collagen: an innovative biomaterial
There were a lot of things on the development of OCP/Collagen, but we’ve done a pretty good job. Until then, the mainstream of bone substitutes was a baked biomaterial, such as hydroxyapatite, which is adapted on the body but doesn’t go through the bone remodeling cycle. It didn’t have any bad effects but didn’t have any change too. The next biomaterial that emerged was beta-TCP, but it dissolved quickly. Unlike those biomaterials, OCP/Collagen has been found to promote osteoblast differentiation and induce blood vessels. Conventional biomaterials only regenerate bone from around the bone, whereas with OCP/Collagen, bone is formed even from the middle of the material. That’s why the regeneration speed is so fast. We are thinking of applying it mainly in dentistry, but I think it can be applied to orthopedics as well. A cleft jaw can be applied to treat patients with cracked gums. We are awaiting sales and have patients waiting for it.
続けることの力
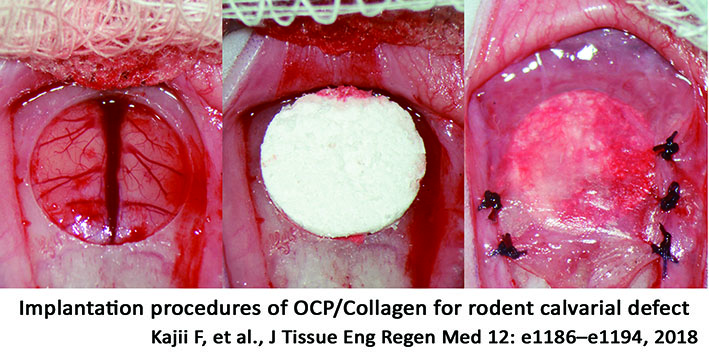
研究室を構えてから、僕はこの研究テーマ一本でやってきました。逆に言うと、それしかやらなかった。でもコストパフォーマンスはピカイチだと思います。材料は提供してもらいましたし、本当にお金かかっていないです。ラットの頭蓋骨にきれいに大きな穴をあけて、生体材料で埋める。それだけです。でも、実は穴をあけることがすごく難しい。大きな穴を開けることで、確実にその材料の本当の能力がわかる。みんなちっちゃい穴を開けて、あるいは、骨をちょっと掻き取るだけなので良い結果が出ないんですよ。
極論を言えば、僕が教授になれたのは、この手技ができたから。もともとは文献ににあった手技なんですけど、確立するまで大変だから、みんなやらない。たまに、この実験系を使いたいという相談を受けるんですが、頑張って2年くらいはかかリますよって言うと、じゃあやめますって。そりゃそうですよね。手技を身に着けてからが勝負ですからね。
よく、研究テーマこれ一本で怖くなかったんですかって言われます。僕の答えは、「怖いと思っている余裕がなかった」。多分、ふと正気にかえったら恐ろしかったと思うんですけど、恐怖や不安を感じている暇がなかった、というのが正直なところです。特に、OCPコラーゲンの開発を始めた頃はそうでした。さっき言ったように業績あげなきゃいけないを切実に思っている時期だったので。僕はあと2年ほどで退官なので、続きは誰かやりたい人がやってもらうしかないです。でも、OCPコラーゲンがもっと普及すれば、これを使って続きをやる人は絶対出てくると思います。臨床の症例で、OCPコラーゲンの性能評価とその限界を明らかにしてくれると思っています。
Perseverance is the key to success
Since I set up my lab, I’ve been working on this single research topic. In other words, that’s all I did. But the cost-effectiveness is superb. I was provided with the materials from the company. It really didn’t cost a lot of money. I made a big hole in the rat’s skull and filled it with biomaterial. That’s all. But it’s actually very difficult to make an exact hole. By drilling a big hole, you can definitely see a real feature of the biomaterials. Everyone else just makes a tiny hole or scrapes a little bit of bone, so they don’t get good results.
To put it another way, I became a professor because I was able to do this technique. It was originally a technique that was reported in the paper, but it’s not easy to establish, so people don’t do it. Occasionally, I was approached by people who wanted to use this experimental system, but when I told them it will take a couple of years of hard work to learn it, they’ve given up. I understand them because the research just starts after they learn the technique.
I’m often asked, “Weren’t you scared by only one research topic you have?” My answer is, “I couldn’t afford to be scared.” I was probably scared when I realized the situation, but to be honest, I didn’t have time to feel fear or anxiety, especially, when we started developing OCP/Collagen. As I said before, I was desperately aware of the need to perform well. As I will be retiring in about two years, I hope someone else continues the research. If OPC collagen becomes more popular, some people will want to use it. I believe that clinical cases will help us evaluate the performance of OCP/Collagen and clarify its limitations.
医工融合のこれから
2008年に医工学研究科が設置されてから12年立ちましたが(2020年時点)、医学系と工学系の融合は、まだまだだと思います。さすがに10年ぐらい経って、お互い違う言語を話していたんだなってことは認識できていると思いますし、お互いの文化に対する相互理解は深まったと思います。学生を教育していて、工学部出身の学生を見ていて面白いのは、彼らは常に数字・正確さにこだわるんですね。だけど、僕らが試料を観察するときは、非常に定性的で、もわーっとした感じ。でも、彼らはそんなことが許せないんでしょうね。誤差なんかも、例えば直径9ミリで設計したら、9ミリのものしか作らない。だけど、手術をやれば1ミリ2ミリは平気で違ってくるし、そのくらいの誤差に対応できるようなフレキシブルな医療機器じゃなければ、現場では絶対使ってもらえないと思います。10%くらいの誤差は吸収してって言うんですけど、彼らはそんなこと絶対許してくれしてない(笑)。
医療機器について、よく話をするのは、スマホとかだったら開発した人が自分で使って良し悪しを判断できるじゃないですか。でも、一般の機器と違って、医療機器は自分ではまず使わない。使うのは医療従事者と患者さん、つまりエンジニアリングの素人です。例えばある医療機器があるとして、準備に3時間かかるけどすごく性能がいい、精度100%の機器と、10分で準備できて精度80%でる機器があるとしたら、現場の医者はどっちを使いますか? 10分で80%の機械ですよね。実際、医療の現場では時間の制約があって、性能・精度はそこそこでもいいから、とにかく時間優先。患者さんの命がかかってるから。僕ら医療従事者は、エンジニアからしたらずいぶんいい加減な世界に生きてると思うんですけど、そのいい加減さを理解してほしいなとは思います。
医療従事者は、常にエンジニアに助けてほしいと思っているはずです。普通のお医者さんは工学の知識もないし、エンジニアの助けがなければ何も作れないです。だから、少しでも、医療従事者のニーズとエンジニアが提供できる技術が合致したら、素晴らしいものができると思います。医工学研究科ができて12年たって、医工融合の土壌はできてきたと思います。10年耕して、つぎの10年で収穫。講義をしていても次世代が育っている実感はありますね。
The future of medical-engineering integration
12 years have been passed since the Graduate School of Biomedical Engineering started in 2008 (as of 2020). But I think the integration of the medical and engineering fields is still on the way. As you would expect after 10 years, we’ve come to realize that we spoke different languages, and mutual understanding of each other’s cultures has deepened. What is interesting to me about engineering students is that they are always obsessed with numbers and accuracy. But when I observe the samples, they are very qualitative and vague. I guess they can’t tolerate such vague things. For example, if you design a sample with a diameter of 9 millimeters, you can only make a sample with a diameter of 9 millimeters. I tell them to be flexible and allow a margin of error of 10%, but they would never allow it.
I often talk about medical devices; smartphones, for example, the people who developed them can use them themselves and judge whether they are good or bad, but unlike ordinary devices, medical devices are not used by the developers. They are used by medical professionals and patients, in other words, laymen in engineering. For example, let’s say there is a certain medical device that takes three hours to prepare, but it’s a very high performance and has 100% accuracy and another device that can be prepared in 10 minutes and has 80% accuracy, which one would a doctor use? It’s an 80% machine ready in 10 minutes. In fact, in the medical field, there is a time constraint, and time is the priority anyway, even if the performance and accuracy are so-so because patients’ lives are at stake. From the point of view of an engineer, we medical personnel live in a world of uncertainty, and I hope that they understand that uncertainty.
I’m sure that medical professionals always want engineers to help them. Ordinary doctors have no knowledge of engineering, and they can’t make anything without the help of engineers. So if we can match, even just a little bit, the needs of the medical profession and the technology that engineers can provide, I think we can create something great. Twelve years after the establishment of the Graduate School of Biomedical Engineering, I think we’ve laid the foundation for the integration of medicine and engineering. Grow it for 10 years and harvest it in the next 10 years. I get the sense that the next generation is growing, even when I give lectures.
